全球新药进展第4位!中国生物制药以40款新药进展领跑行业
Insight数据库报道,2025年全球共有2600多款新药(不含改良新、类似药)进度发生了变化,临床进展数量超过15款的有20家。全球制药企业竞争白热化的背景下,中国生物制药(1177.HK)凭借强劲的研发实力,全年推进40款新药的开发进程,斩获全球新药进展排名第4位,领先多家跨国制药巨头。
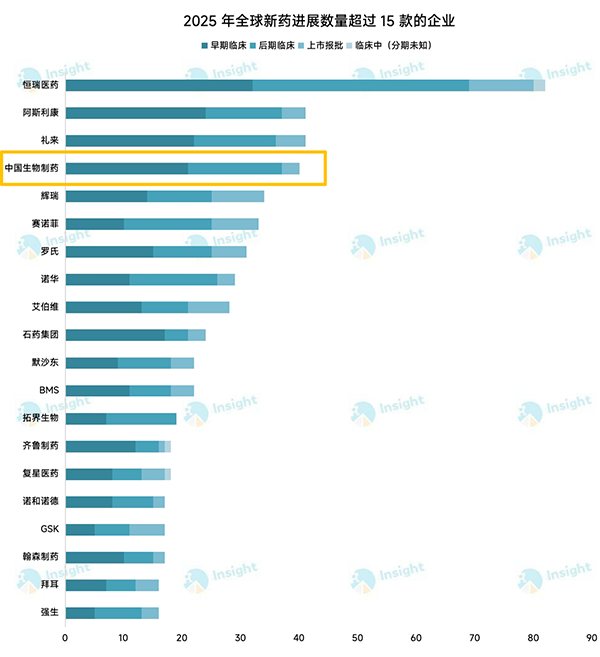
数据说明:来源丁香园Insight数据库全球新药模块,筛选「全球最高进度」≥临床Ⅰ期(包括分期未知的临床)、「项目积极状态」为积极、全球最高状态时间为2024.1.1-2024.12.31、新药类型为新药(不含改良新、类似药)、研发机构为企业(不含大学、医院、研究机构);早期临床=临床Ⅰ期+Ⅰ/Ⅱ期,后期临床=临床Ⅱ期、Ⅱ/Ⅲ期、Ⅲ期,上市报批=批准上市+申请上市。
2025年全球2600多款临床进展的新药中,有131款首次获批,正式开启商业化征程,还有111款递交上市申请,250余款在开展Ⅲ期临床。中国生物制药在自研和引进的双轮驱动下,共有40款新药进度发生了变化,比2024年多了近10款。
从进度来看,中国生物制药共有2款1类新药获批上市。2025年12月9日,全球首个CDK2/4/6抑制剂库莫西利胶囊(赛坦欣®)正式获批,联合氟维司群,用于既往接受内分泌经治的HR+/HER2-局部晚期或转移性乳腺癌患者。作为正大天晴自主研发的新一代三重CDK抑制剂,库莫西利对于临床上CDK4/6抑制剂耐药、减轻骨髓抑制问题,提供了全新的治疗方案。
同年8月,中国生物制药与勃林格殷格翰联合在中国大陆推广的宗艾替尼片(圣赫途®)正式获批,用于治疗存在HER2(ERBB2)激活突变且既往接受过至少一种系统治疗的不可切除的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。作为全球首个且目前唯一在中国获批治疗HER2突变晚期NSCLC的口服靶向药,宗艾替尼从2025年1月递交上市许可申请到惠及患者仅用了一年时间,体现了创新疗法快速落地的“中国速度”。
2025年,中国生物制药共达成了5笔医药交易。其中,7月与礼新医药的收购交易,不仅打响了国内创新药内并第一枪,也为自身管线的创新发展按下了加速键。收购完成后,礼新医药的双抗、ADC等技术平台一起加入中国生物制药,进一步强化中国生物制药在前沿分子类型和肿瘤免疫领域的研发能力,推动公司的全面创新和国际化业务再加速。
2025年,中国生物制药在双抗、PROTAC、ADC等生物药类型全面发力。年内有3款双抗进入了Ⅲ期临床阶段,分别是HER2双抗TQB2930、PD-1/TGFB双抗TQB2868和CD3/CD20双抗TQB2825。另外,还有3款蛋白降解靶向嵌合体(PROTAC)和4款抗体偶联药物(ADC,包括双抗ADC)正在开展早期临床。2025年,共有18款新药首次获批临床,涵盖肿瘤、代谢、外科/镇痛、呼吸等核心治疗领域。
信息来源:丁香园Insight数据库公众号
 简体中文
简体中文 English
English















